Pada akhir abad ke-19, ahli kimia Rusia Dmitri Mendeleev menerbitkan percubaan pertamanya untuk mengelompokkan unsur-unsur kimia mengikut berat atomnya. Terdapat hanya kira-kira 60 elemen yang diketahui pada masa itu, tetapi Mendeleev menyedari bahawa apabila unsur-unsur itu dianjurkan oleh berat, beberapa elemen tertentu berlaku dalam jangka masa yang tetap atau tempoh.
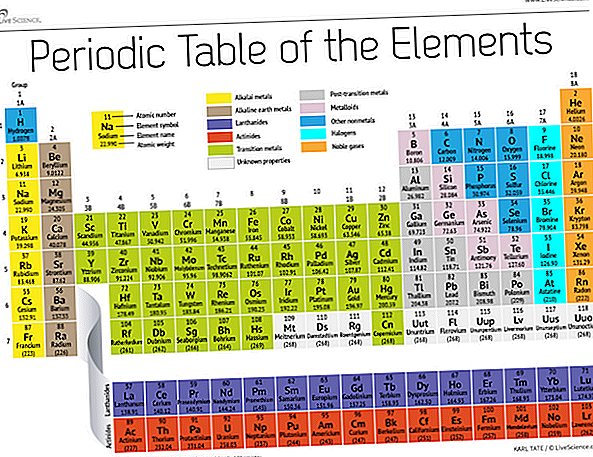
Kini, 150 tahun kemudian, ahli kimia secara rasmi mengiktiraf 118 elemen (selepas penambahan empat pendatang baru pada 2016) dan masih menggunakan jadual berkala Mendeleev untuk menyusunnya. Jadual ini bermula dengan atom paling mudah, hidrogen, dan kemudian menganjurkan sisa elemen-elemen dengan nombor atom, iaitu bilangan proton yang masing-masing mengandungi. Dengan beberapa pengecualian, susunan unsur sepadan dengan jisim yang meningkat setiap atom.
Jadual ini mempunyai tujuh baris dan 18 tiang. Setiap baris mewakili satu tempoh; bilangan bilangan elemen menunjukkan bilangan elektron rumah elektron. Natrium, sebagai contoh, terletak dalam tempoh ketiga, yang bermaksud atom natrium biasanya mempunyai elektron dalam tahap tiga tenaga pertama. Melangkah ke bawah meja, tempoh lebih lama kerana ia memerlukan lebih banyak elektron untuk mengisi tahap luaran yang lebih besar dan lebih kompleks.
Lajur jadual mewakili kumpulan, atau keluarga, unsur-unsur. Unsur-unsur dalam suatu kumpulan sering kali kelihatan dan berkelakuan sama, kerana mereka mempunyai jumlah elektron yang sama dalam shell luar mereka - wajah yang mereka tunjukkan kepada dunia. Kumpulan 18 elemen, di bahagian paling kanan meja, misalnya, mempunyai kulit luar sepenuhnya dan jarang menyertai reaksi kimia.
Elemen biasanya dikelaskan sebagai sama ada logam atau bukan logam, tetapi garis pemisah antara kedua-dua adalah kabur. Unsur logam biasanya konduktor elektrik dan haba yang baik. Subkumpulan dalam logam adalah berdasarkan ciri-ciri dan sifat-sifat kimia koleksi ini. Keterangan kami tentang jadual berkala menggunakan pengelasan elemen yang diterima secara umum, menurut Makmal Kebangsaan Los Alamos.
Logam alkali: Logam alkali terdiri daripada kebanyakan Kumpulan 1, lajur pertama jadual. Berkilat dan lembut untuk dipotong dengan pisau, logam ini bermula dengan litium (Li) dan berakhir dengan francium (Fr). Mereka juga sangat reaktif dan akan meletupkan nyala api atau meletup ketika bersentuhan dengan air, jadi ahli kimia menyimpannya dalam minyak atau gas lengai. Hidrogen, dengan elektron tunggal, juga hidup dalam Kumpulan 1, tetapi gas dianggap sebagai bukan logam.
Logam alkali tanah: Logam alkali tanah membentuk Kumpulan 2 jadual berkala, dari berilium (Be) melalui radium (Ra). Setiap elemen ini mempunyai dua elektron dalam tahap tenaga paling luar, yang membuat bumi alkali menjadi cukup reaktif sehingga jarang ditemui bersendirian. Tetapi mereka tidak reaktif sebagai logam alkali. Reaksi kimia mereka biasanya lebih perlahan dan menghasilkan kurang haba berbanding dengan logam alkali.
Lanthanides: Kumpulan ketiga adalah terlalu panjang untuk dimuatkan ke dalam lajur ketiga, sehingga dipecah dan dibalik ke tepi untuk menjadi barisan atas pulau yang mengapung di dasar meja. Ini adalah lanthanides, elemen 57 hingga 71 - lanthanum (La) hingga lutetium (Lu). Unsur-unsur dalam kumpulan ini mempunyai warna putih keperakan dan menjejaskan hubungan dengan udara.
Actinides: Actinides merangkumi barisan bawah pulau dan mengandungi unsur-unsur 89, actinium (Ac), melalui 103, lawrencium (Lr). Daripada unsur-unsur ini, hanya thorium (Th) dan uranium (U) berlaku secara semula jadi di Bumi dalam jumlah yang banyak. Semua radioaktif. Actinides dan lanthanides bersama membentuk satu kumpulan yang dikenali sebagai logam peralihan batin.
Logam peralihan: Kembali ke bahagian utama meja, baki Kumpulan 3 hingga 12 mewakili seluruh logam peralihan. Sulit tetapi mudah dibentuk, berkilat, dan mempunyai kekonduksian yang baik, unsur-unsur ini adalah apa yang biasa anda fikirkan apabila anda mendengar perkataan logam. Banyak hits terbesar dunia logam - termasuk emas, perak, besi dan platinum - tinggal di sini.
Logam pasca peralihan: Menjelang lompat ke dunia nonmetal, ciri-ciri yang dikongsi tidak dibahagikan dengan kemas sepanjang jalur kelompok menegak. Logam pasca peralihan adalah aluminium (Al), gallium (Ga), indium (In), thallium (Tl), timah (Sn), plumbum (Pb) dan bismuth (Bi). Unsur-unsur ini mempunyai ciri-ciri klasik dari logam peralihan, tetapi mereka cenderung lebih lembut dan melakukan lebih buruk daripada logam peralihan yang lain. Banyak jadual berkala akan menampilkan garis tebal "tangga" di bawah boron penyeberangan pepenjuru dengan astatine. Kluster logam pasca-peralihan ke kiri bawah baris ini.
Metaloid: Metalloids adalah boron (B), silikon (Si), germanium (Ge), arsenik (As), antimonim (Sb), tellurium (Te) dan polonium (Po). Mereka membentuk tangga yang mewakili peralihan beransur-ansur dari logam kepada nonmetals. Unsur-unsur ini kadang-kadang berkelakuan sebagai semikonduktor (B, Si, Ge) dan bukan sebagai konduktor. Metalloids juga dipanggil "semimetals" atau "logam miskin."
Nonmetals: Segala yang lain di bahagian atas kanan tangga - ditambah hidrogen (H), terdampar kembali ke dalam Kumpulan 1 - adalah nonmetal. Ini termasuk karbon (C), nitrogen (N), fosforus (P), oksigen (O), sulfur (S) dan selenium (Se).
Halogens: Empat elemen utama Kumpulan 17, dari fluorin (F) melalui astatine (At), mewakili satu daripada dua subset dari nonmetals. Halogen agak reaktif kimia dan cenderung berpasangan dengan logam alkali untuk menghasilkan pelbagai jenis garam. Garam meja di dapur anda, sebagai contoh, adalah perkahwinan antara natrium logam alkali dan klorin halogen.
Gas mulia: Ramai ahli kimia mengharapkan oganesson, salah satu dari empat elemen yang baru dinamakan, untuk berkongsi ciri-ciri ini, yang tidak berwarna, tidak berbau dan hampir tidak sepenuhnya aktif, gas yang lengai atau mulia. Walau bagaimanapun, kerana unsur ini mempunyai ukuran separuh hayat dalam milisaat, tiada siapa yang dapat mengujinya secara langsung. Oganesson melengkapkan tempoh ketujuh jadual berkala, jadi jika sesiapa berjaya untuk menyusun elemen 119 (dan perlumbaan untuk melakukannya sudah dijalankan), ia akan dilingkari sekitar untuk memulakan baris lapan dalam lajur logam alkali.
Kerana sifat kitaran yang dicipta oleh periodicity yang memberikan nama namanya, beberapa ahli kimia memilih untuk memvisualisasikan jadual Mendeleev sebagai bulatan.
Tambahan sumber: